Kwas vs. zasada
Zawartość
- Zawartość: Różnica między kwasem a zasadą
- Wykres porównania
- Co to są kwasy?
- Jakie są zasady?
- Kluczowe różnice
- Wniosek
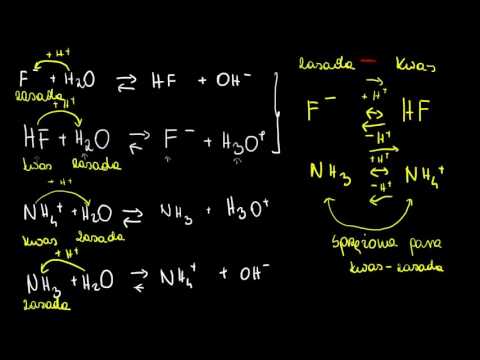
Różnicę między kwasem a zasadą można określić, ponieważ kwasy są substancjami żrącymi, które mają zdolność dawania protonu i przyjmowania elektronu z innej substancji, podczas gdy zasady są substancjami żrącymi, które mają zdolność przyjmowania protonu i oddawania elektronu inne substancje.

Zarówno kwasy, jak i zasady to rodzaje substancji żrących. Kwasy są rodzajem związków jonowych, które dysocjują w wodzie i oddają jon wodoru (H +). Zasady są także rodzajem związków jonowych. Rozpadają się również w wodzie i oznaczają jon hydroksylowy (OH-). Oznacza to, że kwasy są związkami po rozpuszczeniu w wodzie, wytwarzając roztwór o stężeniu jonów wodoru większym niż czysta woda. I odwrotnie, zasady są związkami, które po rozpuszczeniu w wodzie wytwarzają roztwór o stężeniu jonu wodoru niższym niż czysta woda.
W skali pH kwasy mają pH od 0 do mniej niż 7, podczas gdy zasady mają pH od 7 do 14. Kwasy mogą występować w dowolnych stanach fizycznych, tj. Ciałach stałych lub cieczach lub gazach w zależności od temperatury, ciśnienia i innych czynników fizycznych warunki. Zasady znajdują się głównie w postaci stałej, z wyjątkiem amoniaku, który występuje w stanie gazowym. Kwasy są lepkie, podczas gdy bazy mają śliską konsystencję, ponieważ reagują z olejami naszych rąk. Smak kwasów jest kwaśny, podczas gdy smak zasad jest gorzki. Kwas reaguje z metalami. Kwasy wytwarzają gazowy wodór po reakcji, podczas gdy zasady reagują z olejami i tłuszczami. Siła kwasów zależy od stężenia jonów wodoru. Im większe stężenie jonów wodoru, tym silniejsze są kwasy. Siła zasad zależy od stężenia jonów hydroksylowych. Im większe stężenie jonów hydroksylowych, tym silniejsza jest zasada.
Kwasy są naładowane dodatnio z powodu obecności dodatnio naładowanych jonów wodoru, podczas gdy zasady mają na nich ładunek ujemny z powodu obecności w nich jonów OH-. Kwasy nie wykazują zmiany koloru w przypadku fenoloftaleiny, podczas gdy zasady nadają jej różowy kolor.Wzór chemiczny kwasów zaczyna się od H, (wodór), na przykład HCL (kwas chlorowodorowy), H2SO4 (kwas siarkowy). Ale po tej regule nie stosuje się kwasu octowego (CH3COOH), którego wzór chemiczny nie zaczyna się od H. Wzór chemiczny zasad kończy się na OH. Na przykład wodorotlenek sodu (NaOH). Kwasy i zasady wykazują również reakcję z lakmusem. Kwasy zmieniają niebieski papier lakmusowy na czerwony, a bazy zmieniają czerwony papier lakmusowy na niebieski. Zarówno kwasy, jak i zasady mogą przewodzić prąd elektryczny z powodu dysocjacji wolnych jonów między nimi.
Kwasy są stosowane do czyszczenia zardzewiałych metali, w produkcji nawozów, jako dodatki w żywności i napojach, jako elektrolity w akumulatorach i w przetwarzaniu minerałów. Są również stosowane jako konserwanty, jako napoje gazowane, w przemyśle skórzanym oraz do produkcji napojów gazowanych i aromatów do żywności itp.
Podstawy mają zdolność usuwania plam, dlatego są używane do zmywania naczyń, detergentów, środków do prania i środków do czyszczenia piekarników. Są również stosowane w lekach na żołądek, tj. Leki zobojętniające sok żołądkowy, w dezodorantach pod pachami i w celu neutralizacji kwasów.
Zawartość: Różnica między kwasem a zasadą
- Wykres porównania
- Co to są kwasy?
- Jakie są zasady?
- Kluczowe różnice
- Wniosek
Wykres porównania
| Podstawa | Kwas | Baza |
| Koncepcja Arrhenius | Kwasy to związki, które mają zdolność oddawania jonów H + po rozpuszczeniu w wodzie. | Baza jest substancją zdolną do oddawania jonów OH- po rozpuszczeniu w wodzie. |
| Lowry Bronsted Concept | Kwasy mają zdolność dawania protonów innym substancjom. | Zasady mają zdolność przyjmowania protonów z innych substancji. |
| Koncepcja Lewisa | Substancje, które są elektrofilami, mają pusty orbit i mają zdolność przyjmowania pary elektronów, nazywane są kwasami Lewisa. | Substancje, które są nukleofilami, mają pojedynczą parę elektronów i mają zdolność oddawania pary elektronów, nazywane są zasadami Lewisa. |
| Reakcja z wodą | Po zmieszaniu kwasu z wodą powstaje roztwór o stężeniu jonów H + większym niż czysta woda. | Po zmieszaniu zasady z wodą powstaje roztwór o stężeniu H + mniejszym niż czysta woda. |
| zakres pH | Ich pH wynosi od 0 do mniej niż 7. | Ich pH waha się od ponad 7 do 14. |
| Stan fizyczny | Mogą wystąpić dowolny ze stanów fizycznych, tj. Ciecze, ciała stałe lub gazy. | Występują głównie w stanie stałym, z wyjątkiem amoniaku, który znajduje się w stanie gazowym. |
| Reakcja z papierem lakmusowym | Zmieniają papier lakmusowy w czerwony. | Zmieniają papier lakmusowy w niebieski. |
| Reakcja z fenoloftaleiną | Nie wykazują reakcji z fenoloftaleiną. | Zmieniają fenoloftaleinę w róż. |
| Wzór chemiczny | Wzór chemiczny kwasów zaczyna się od H, np. HNO3 dla kwasu azotowego, H2SO4 dla kwasu siarkowego, HCL dla kwasu solnego. | Ich wzór chemiczny kończy się na OH, np. NaOH dla wodorotlenku sodu, KOH dla wodorotlenku potasu i Ca (OH) 2 dla wodorotlenku wapnia. |
| Konsystencja | Kwasy są lepkie w dotyku. Mają kwaśny smak. | Podstawy są śliskie w dotyku. Mają gorzki smak. |
| Używa | Kwasy są stosowane do czyszczenia zardzewiałych metali, jako dodatki do żywności i napojów, jako elektrolity w akumulatorach, w nawozach i przemyśle skórzanym. | Zasady stosuje się w odplamiaczach, dezodorantach do rękawów, detergentach, lekach zobojętniających kwas oraz w celu neutralizacji kwasów. |
Co to są kwasy?
Słowo „kwas” pochodzi od łacińskiego słowa „acere”, co oznacza kwaśny. Kwas jest jonową i żrącą substancją, która ma zdolność oddawania jonu wodorowego, przyjmowania pary elektronów lub oddawania protonu. Siła kwasu jest mierzona przez stężenie jonów H +. Substancja żrąca to taka, która uszkadza lub niszczy inne substancje mające z nią kontakt. Im wyższe stężenie jonów wodoru, tym silniejszy jest kwas. Kwasowość mierzy się w skali pH. Jest w zakresie od 0 do mniej niż 7. Substancje o niższym pH są bardziej kwaśne i odwrotnie.
Związki jonowe to te związki, które są naładowane dodatnio lub ujemnie. Kwasy są naładowane dodatnio dzięki jonom wodoru.
Silne kwasy to te, które całkowicie dysocjują w wodzie, np. HCL, HNO3 i H2SO4. Kwasy tygodniowe to te, które nie dysocjują całkowicie w wodzie, np. Kwas octowy (CH3COOH).
Materiały genetycznie ważne, tj. DNA (kwas dezoksyrybonukleinowy) i RNA (kwas rybonukleinowy) są również kwasami. Życie bez nich nie jest możliwe. Ocet to powszechnie stosowany kwas domowy.
Jakie są zasady?
Zasady są jonowymi i żrącymi substancjami, które mają zdolność przyjmowania jonu wodorowego, dawania pary elektronów lub przyjmowania protonu z dowolnej innej substancji. Siła zasad jest mierzona przez stężenie jonów OH-. Im większe stężenie jonów OH-, tym silniejsza jest zasada. Zakres zasad wynosi od więcej niż 7 do 14 w skali pH. Wysokie pH wskazuje na większą siłę zasady. Zasady są naładowane ujemnie z powodu obecności jonów OH-.
Silnymi zasadami są te zasady, które są całkowicie zdysocjowane do wody, np. NaOH, tj. Wodorotlenek sodu i KOH, tj. Wodorotlenek potasu.
Podstawami tygodniowymi są osoby, które nie są całkowicie zdysocjowane w wodzie, np. NH3, tj. Amoniak. Nie ma jonów wodorotlenkowych i tworzy tygodniową bazę tylko po rozpuszczeniu w wodzie. Innymi przykładami powszechnie stosowanych baz domowych są boraks, soda oczyszczona i mleko magnezowe (stosowane jako lek na żołądek).
Kluczowe różnice
Najważniejsze różnice między kwasem a zasadą podano poniżej:
- Zarówno kwasy, jak i zasady są substancjami żrącymi. Kwas może dawać jon wodoru lub proton lub przyjmować parę elektronów. Zasady mogą przyjmować jon wodoru lub proton lub dawać parę elektronów.
- Kwasy mają kwaśny smak i są lepkie w dotyku. Bazy mają gorzki smak i są śliskie w dotyku.
- Wzór chemiczny kwasów zaczyna się od H, np. HCL, HNO3, natomiast zasad zasad kończy się na OH, np. KOH, NaOH itp.
- Kwasy zmieniają papier lakmusowy w czerwony, a podstawy zmieniają go w niebieski.
- W skali pH kwasy mają pH mniejsze niż 7, podczas gdy zasady mają pH większe niż 7.
Wniosek
Kwasy i baza mają podstawowe znaczenie w chemii, a także w naszym codziennym życiu. Warto o nich wiedzieć. W powyższym artykule omówiliśmy różnice w kwasach i zasadach, ich właściwościach fizycznych i chemicznych oraz trzy teorie, aby zrozumieć ich naturę.





